La ranitidina, un bloqueador de los receptores histamina H2 (histamina-2), que disminuye la cantidad de ácido creado por el estómago, es retirado del mercado farmacéutico.
La molécula, hasta el 1 de abril, se podía comercializar bajo dos formas:
- De venta libre: aprobada para prevenir y aliviar la acidez estomacal asociada con la ingestión de ácido y el ardor de estómago.
- De venta bajo receta médica: aprobada para múltiples indicaciones, incluyendo el tratamiento y la prevención de úlceras estomacales e intestinales y el tratamiento de la enfermedad de reflujo gastroesofágico.
Historia de la ranitidina
La ranitidina fue desarrollada por un grupo de investigadores de Glaxo (hoy día GlaxoSmithKline), en los laboratorios de Allen & Handburys Ltd. en Ware (Inglaterra), donde sustituyeron el anillo imidazol de la cimetidina por un anillo furano. Surge así, en 1976 el clorhidrato de ranitidina comercializado por Glaxo en el año 1981 con el nombre comercial de zantac. El cual presenta una acción más prolongada, diez veces más activa y con menos efectos adversos que la cimetidina (Rubira, 2008. Pág. 611).
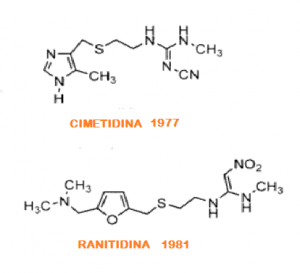
NDMA presente en la ranitidina
¿Qué son las nitrosaminas?
“Las nitrosaminas, o, más correctamente, N-nitrosoaminas (NDMA, por sus siglas en inglés) son moléculas que contienen un grupo funcional nitroso y que suscitan preocupación debido a que sus impurezas podrían ser cancerígenas para el ser humano.
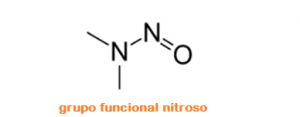
Esta sustancia es un contaminante ambiental conocido y se encuentra en el agua y los alimentos, incluyendo carnes, productos lácteos y vegetales, sin embargo, su presencia en un medicamento se considera inaceptable.” Declara la OMS.
Se ha sabido que algunos medicamentos, incluido la ranitidina y el propio Zantac, contienen una impureza de nitrosamina en niveles bajos.
No obstante, la FDA que venía evaluando desde hace un año si los bajos niveles de NDMA presentes en la ranitidina representan un riesgo para los pacientes, hoy 1 de abril del 2020, ha decidido que sí son un riesgo y decide retirar del mercado todas las presentaciones del medicamento, incluido los líquidos.
“La agencia ha determinado que la impureza en algunos productos de ranitidina aumenta con el tiempo y cuando se almacena a temperaturas superiores a la temperatura ambiente y puede provocar la exposición del consumidor a niveles inaceptables de esta impureza”. FDA
Por tal razón, aconseja a los consumidores que dejen de tomar de inmediato este medicamento, tanto la ranitidina de venta libre como de venta bajo formula médica, y que lo desechen de manera adecuada.
Además, hace la claridad: “hasta la fecha, las pruebas de la FDA no han encontrado NDMA en famotidina, cimetidina, Esomeprazol, lansoprazol u Omeprazol.
Escrito por: Héctor Isaza montoya
Regente de farmacia
Bibliografía
Rubira, E. R. (2008). Medicamentos: Un viaje a lo largo de la evolución del descubrimiento de fármacos (Vol. 1). Univ Santiago de Compostela.